




Radiofarmacja jest nauką zajmującą się wytwarzaniem i badaniem radiofarmaceutyków, czyli substancji znakowanych izotopami promieniotwórczymi używanych w diagnostyce oraz terapii. Różnica między radiofarmacją i farmacją jest więc podobna, jak między radiochemią i chemią. Substancje (farmaceutyki) są tutaj łączone z atomami promieniotwórczymi tworząc radiofarmaceutyki (radioznaczniki).
Istotą radiofarmacji jest wytwarzanie takich substancji, które będą naśladować swoim zachowaniem znane związki naturalne lub znane leki (będą do nich podobne chemicznie), ale dzięki połączeniu z atomem radioaktywnym ich obecność w narządzie może zostać wykryta i zmierzona.
Najważniejszymi problemami, z jakimi musimy się zmierzyć w procesie wytwarzania radiofarmaceutyków, oprócz oczywiście bardzo szerokiego tematu bezpieczeństwa radiologicznego, jest krótki czas fizyczny połowicznego zaniku danego nuklidu. Z tego względu proces wytwarzania potrzebnej substancji nie może trwać zbyt długo. Inaczej rzecz ujmując: struktura chemiczna radiofarmaceutyku musi pozwalać na szybkie jego otrzymanie. Z tego samego względu substancje te w postaci gotowej do użycia są często wytwarzane bezpośrednio w ośrodku, który je podaje pacjentowi.
Problem radiolizy, czyli rozkładu związku chemicznego pod wpływem promieniowania jonizującego, zdaje się mieć w radiofarmacji mniejsze znaczenie, niż w przypadku radiochemii przemysłowej - głównie ze względu na stosowanie niższych aktywności.
Aby ominąć kłopoty związane ze skomplikowanymi procedurami chemicznymi w procesie przygotowywania radiofarmaceutyków, w praktyce stosuje się t.zw. "kity". Są to gotowe zestawy kilku substancji w kilku naczyniach, które zgodnie z załączoną instrukcją należy w odpowiedniej kolejności połączyć ze sobą i ze znakującym izotopem. Odbywa się to w warunkach łatwych do odtworzenia w nawet niezbyt zaawansowanym laboratorium. Oprócz niepodważalnych zalet rozwiązanie to posiada wady. Najważniejszą z nich jest najczęściej wysoka cena.
Radiofarmaceuci pracują nie tylko, jak to zostało wspomniane powyżej, bardzo szybko, ale także z bardzo niewielkimi (nieodważalnymi, niezauważalnymi) ilościami substancji. Ilości te są tym mniejsze, im niższa jest masa cząsteczkowa danej substancji oraz im krótszy jest czas połowicznego zaniku wchodzącego w jej skład nuklidu znakującego. Dla przykładu: typowa aktywność nadtechnetanu sodu (Na99mTcO4), jaką stosuje się w diagnostyce gruczołu tarczowego, wynosi
Przeliczać masę substancji promieniotwórczej na aktywność oraz odwrotnie można tutaj.
Niewielka ilość substancji, z jaką mamy do czynienia, sprawia, że normalne procedury chemiczne i/lub fizyczne, stosowane przede wszystkim do oddzielania gotowych radiofarmaceutyków od pozostałych reagentów, nie sprawdzają się. Na przykład zwykłe wytrącenie z roztworu
(131)Ba2+ + SO42- → (131)BaSO4(↓),
czyli na przykład:
(131)Ba(NO3)2 + Na2SO4 → (131)BaSO4(↓) + 2 NaNO3,
jest po prostu niemożliwe - i to nawet z objętości tak małej, jak
Przy niewielkich ilościach substancji, przy próbie wytrącenia z roztworu innych reagentów (aby na przykład pozostawić w roztworze to, co jest nam potrzebne, a wytrącić to, czego nie potrzebujemy), znaczenia nabiera zjawisko współstrącania (koprecypitacji). Polega ono na tym, że wytrącany osad zabiera ze sobą nieco innych substancji rozpuszczonych w roztworze - mimo, że z prostego rachunku ich stężeń wynika, że wytrącanie nie powinno nastąpić (iloczyn rozpuszczalności nie został przekroczony). Mechanizmy tego zjawiska są trzy: inkluzja (wbudowywanie obcego jonu w sieć krystaliczną - powstaje kryształ domieszkowany, czasem z defektem sieci), okluzja ("zamykanie" obcego jonu w "klatce" kryształu) oraz adsorpcja (łączenie się obcego jonu z powierzchnią kryształu).
Zjawisko współstrącania można wykorzystać dodając do mieszaniny reakcyjnej tak zwanego nośnika (carrier). Jest on substancją o bardzo podobnym charaterze chemicznym do znakującego izotopu (lub substancji znakowanej izotopem) - może to również być tak zwany "zimny" izotop tego samego pierwiastka (lub ta sama/podobna substancja, ale połączona z nieradioaktywnym izotopem). W naszym cytowanym powyżej przykładzie nośnikiem mógłby być zwykły (niepromieniotwórczy) bar. Ilość (stężenie) nośnika w otrzymanej substancji przekracza ilość izotopu promieniotwórczego znacznie - czasami o wiele rzędów wielkości. Obecność nośnika powoduje również, że ilość substancji staje się "odważalna", a substancja posiada niższą aktywność właściwą (wyrażoną w Bq/kg lub w Bq/mol).
W radiofarmacji bazujemy na założeniu, że izotopy (atomy tego samego pierwiastka, charakteryzujące się jednak różną masą) posiadają identyczne właściwości chemiczne. Drobne różnice w kinetyce reakcji są zazwyczaj do pominięcia. Nadmienić jednak należy, że w niektórych sytuacjach w warunkach biologicznych skład izotopowy może mieć takie samo znaczenie, jak właściwości chemiczne. Woda ciężka (czyli zwykły tlenek wodoru, w którym atomy wodoru zostały zastąpione występującym naturalnie w małej ilości ciężkim wodorem, czyli deuterem) jest dla większości organizmów, w tym dla człowieka, trująca...
Znakowaniem promieniotwórczym nazywamy wprowadzanie atomu radioaktywnego do cząsteczki związku chemicznego. Dzięki znakowaniu cząsteczka jest łatwiejsza do wykrycia (staje się "widzialna"). Ma to znaczenie
Istnieją różne sposoby wprowadzania atomów promieniotwórczych do (bardziej lub mniej złożonych) cząsteczek. Między innymi ze względu na wyżej wymienione zjawiska znaczenie w medycynie nuklearnej mają przede wszystkim dwa typy takich połączeń:
I. Związki promieniotwórczych metali
II. Związki promieniotwórczych halogenów (fluorowców - grupa 17, czyli VIIA układu okresowego).
Zwykłe sole (połączenia metali z resztami kwasowymi) podlegają w wodzie dysocjacji elektrolitycznej. Skutkiem tego jest, że substancje (reszty kwasowe) połączone z metalami promieniotwórczymi nie mogłyby stać się radioznacznikami - po wprowadzeniu do organizmu podlegałyby dysocjacji. Dlatego nie badalibyśmy kinetyki całego połączenia, tylko jonu danego metalu (promieniotwórczego). Niektóre jednak kwasy zachowują się inaczej, jeśli zdolne są do utworzenia z danym metalem dodatkowych wiązań koordynacyjnych. Tak utworzona sól jest związkiem kompleksowym, kwas (reszta kwasowa) natomiast nazywany jest chelatorem. W przypadku tego typu soli rozpuszczonej w wodzie nie możemy wykryć jonów danego metalu za pomocą prostych metod analitycznych.
Dość słabym chelatorem jest kwas cytrynowy ("kwasek cytrynowy"). Z silnych środków chelatujących najbardziej znany jest kwas etylenodiaminotetraoctowy (EDTA) - stosowany między innymi jako "odkamieniacz" do instalacji sanitarnych i urządzeń AGD. Struktura chemiczna EDTA przedstawiona jest poniżej.

Wzór strukturalny kwasu etylenodiaminotetraoctowego (EDTA), dodatkowo uwidoczniono wolne pary elektronów przy atomach azotu. Właśnie te pary są odpowiedzialne za chelatowanie.
Poniżej przedstawiono strukturę połączenia EDTA z metalem czterowartościowym. Wiązania kowalencyjne, kowalencyjne spolaryzowane i jonowe zaznaczono liniami ciągłymi, wiązania koordynacyjne strzałkami (zwróconymi
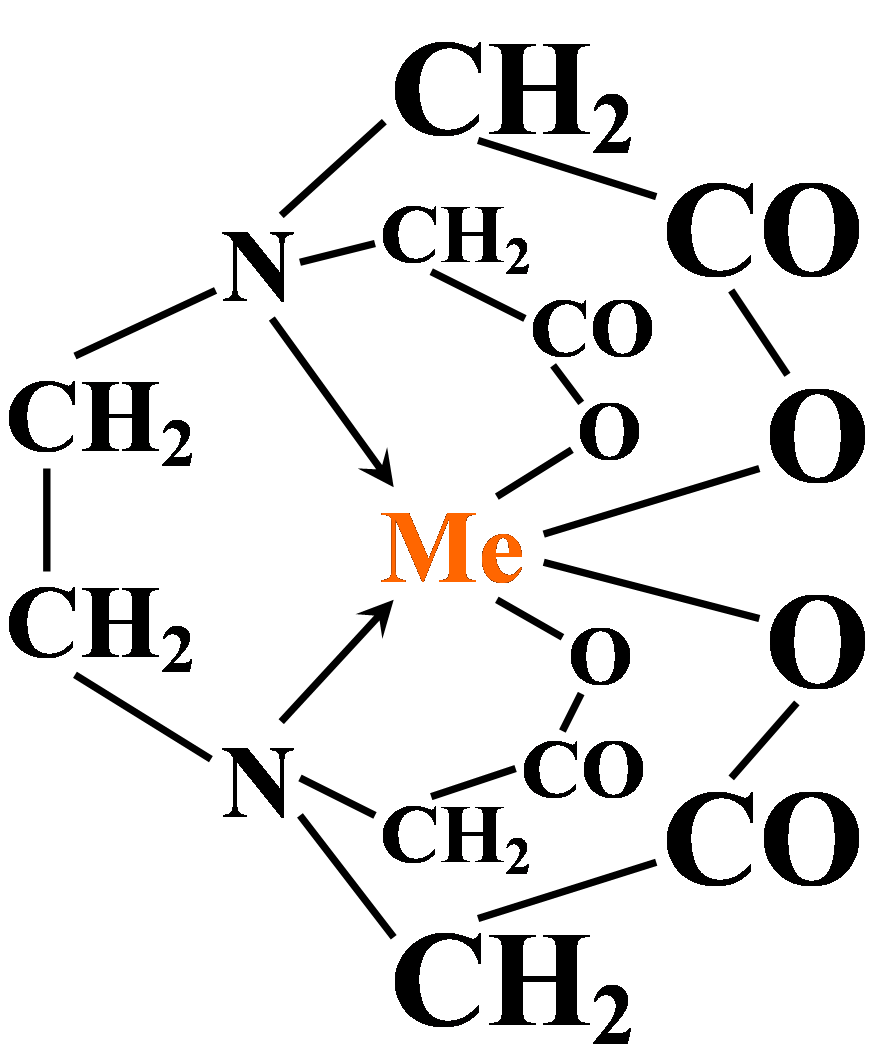
Wzór strukturalny kompleksu EDTA-metal czterowartościowy
EDTA jest najprostszym spośród stosowanych silnych chelatorów. Znane są również "dalsze wersje rozwojowe" tej substancji, jak: kwas dietylenotriaminopentaoctowy (DTPA), kwas cyklononano-1,4,7-triaza-1,4,7-trioctowy (NOTA) i kwas cyklododekano-1,4,7,10-tetraaza-1,4,7,10-tetraoctowy (DOTA). Ich struktury przedstawiono poniżej.
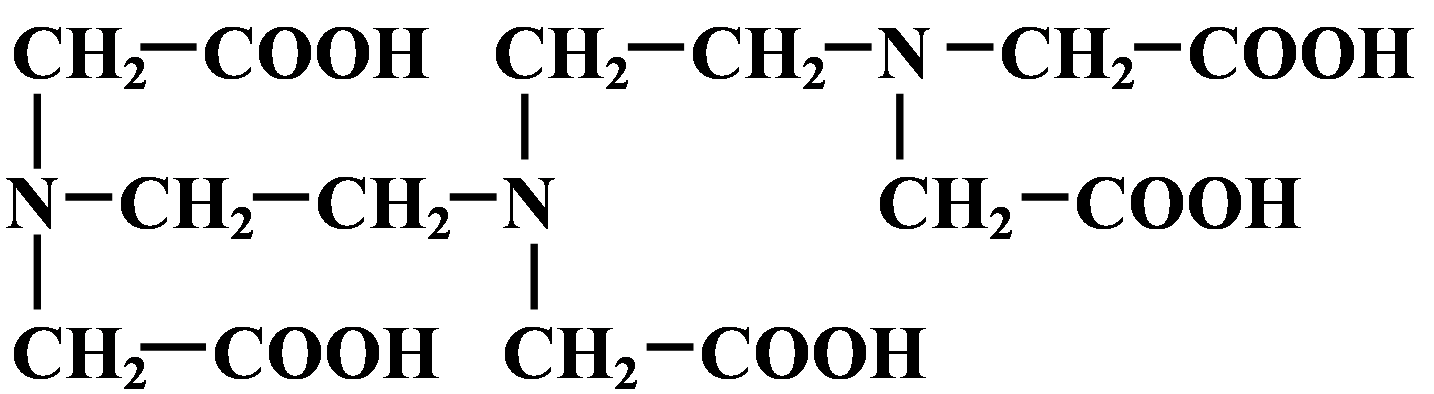
Kwas dietylenotriaminopentaoctowy (DTPA)

Kwas cyklononano-1,4,7-triaza-1,4,7-trioctowy (NOTA)
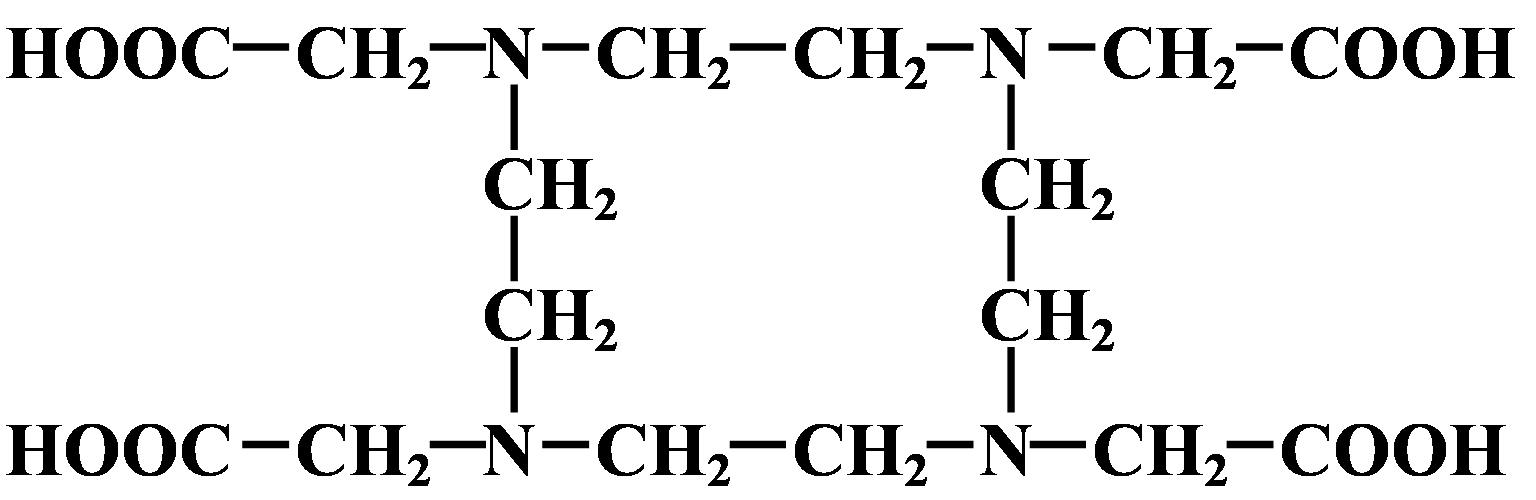
Kwas cyklododekano-1,4,7,10-tetraaza-1,4,7,10-tetraoctowy (DOTA)
Powyższe związki mają bardzo ważne miejsce w medycynie nuklearnej. EDTA jest substancją dekontaminującą w przypadkach skażeń promieniotwórczymi metalami, poza tym w kompleksie z 51Cr bywa (rzadko) stosowany do dokładnego oznaczania kłębuszkowej funkcji nerek (GFR). DTPA w połączeniu z 99mTc jest często stosowany do badania scyntygraficznego nerek. Kompleks ten, jak również z 111In, bywa łączony z większymi molekułami (np. oligopeptydami, oznaczanymi jako TOC, NOC i TATE) do badań obrazowych rozkładu receptorów m.in. somatostatynowych. W tym ostatnim zadaniu jeszcze większą rolę odgrywają NOTA i, zwłaszcza, DOTA.
Przedstawione powyżej chelatory są tylko przykładami zastosowań kompleksów w medycynie nuklearnej. Większość innych połączeń metali promieniotwórczych, ze względu na możliwość dysocjacji w środowisku wodnym, musi być połączeniami komleksowymi.
Oczywiście istnieją również związki metali promieniotwórczych bez (formalnie) wiązań koordynacyjnych. Najczęściej są to związki metaloorganiczne (czyli związki organiczne, w których atom metalu połączony jest bezpośrednio z atomem węgla) oraz zawierające wiązanie siarka-metal. Dokładna struktura tego typu związków w wielu przypadkach nie została jeszcze poznana.
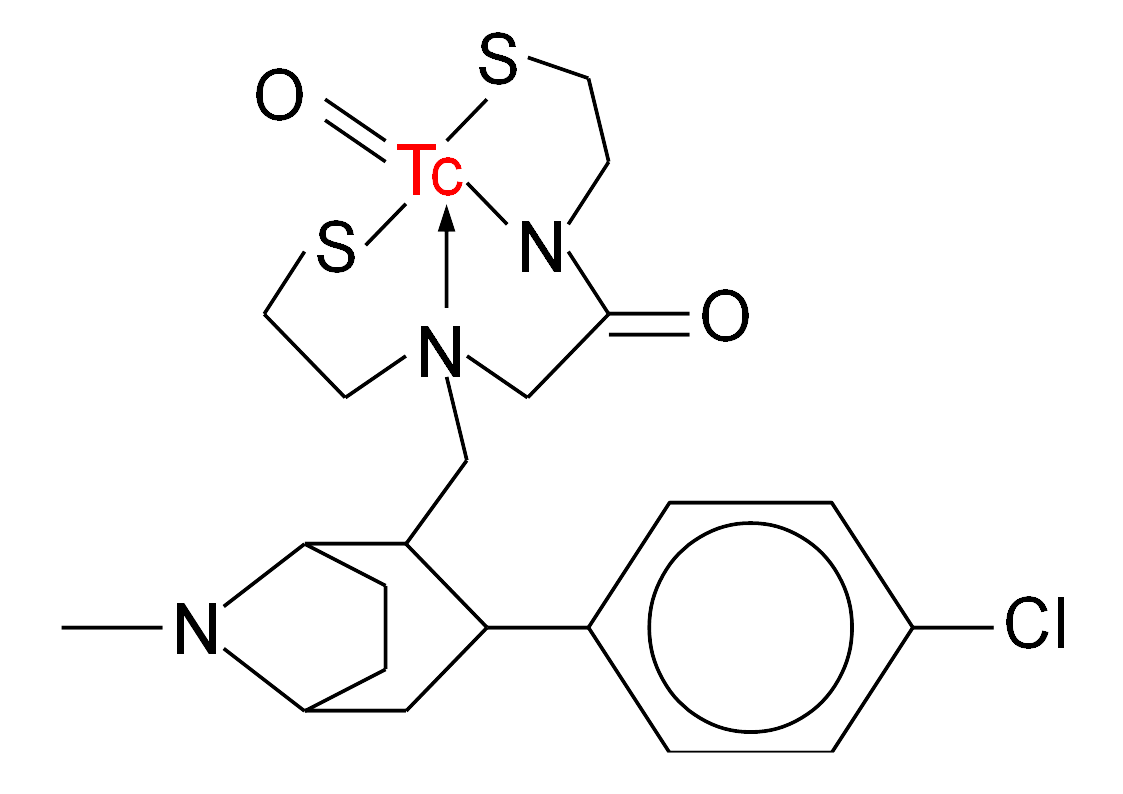
Struktura chemiczna TRODAT-u: połączenie technetu z pochodną kokainy (do badania transporterów dopaminowych w mózgowiu) jako przykład radiofarmaceutyku z wiązaniem metal-siarka
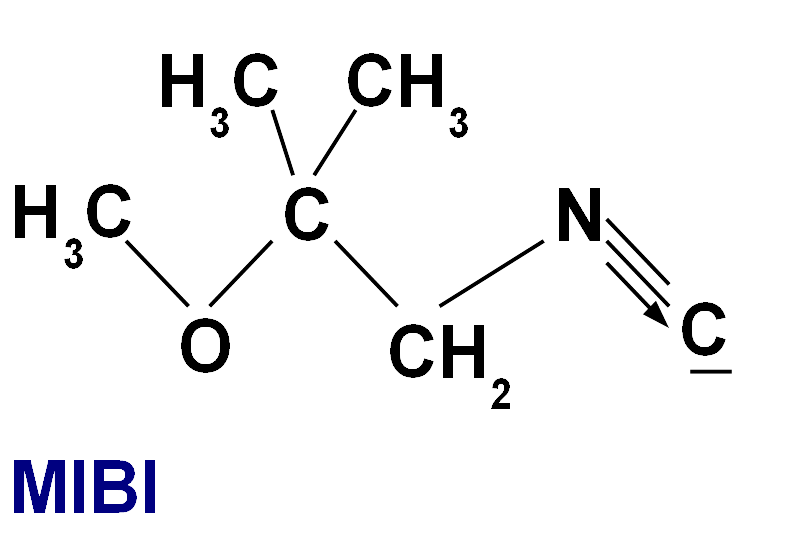
Struktura metoksyizobutyloizonitrylu (MIBI); W skład połączenia z technetem wchodzi najprawdopodobniej sześć takich cząsteczek - stąd nazwy 99mTc-sestaMIBI oraz 99mTc-hexaMIBI. Ma ono charakter kationowy (ładunek dodatni). Znacznik ten wykorzystywany jest w diagnostyce obrazowej serca, przytarczyc oraz w onkologii.
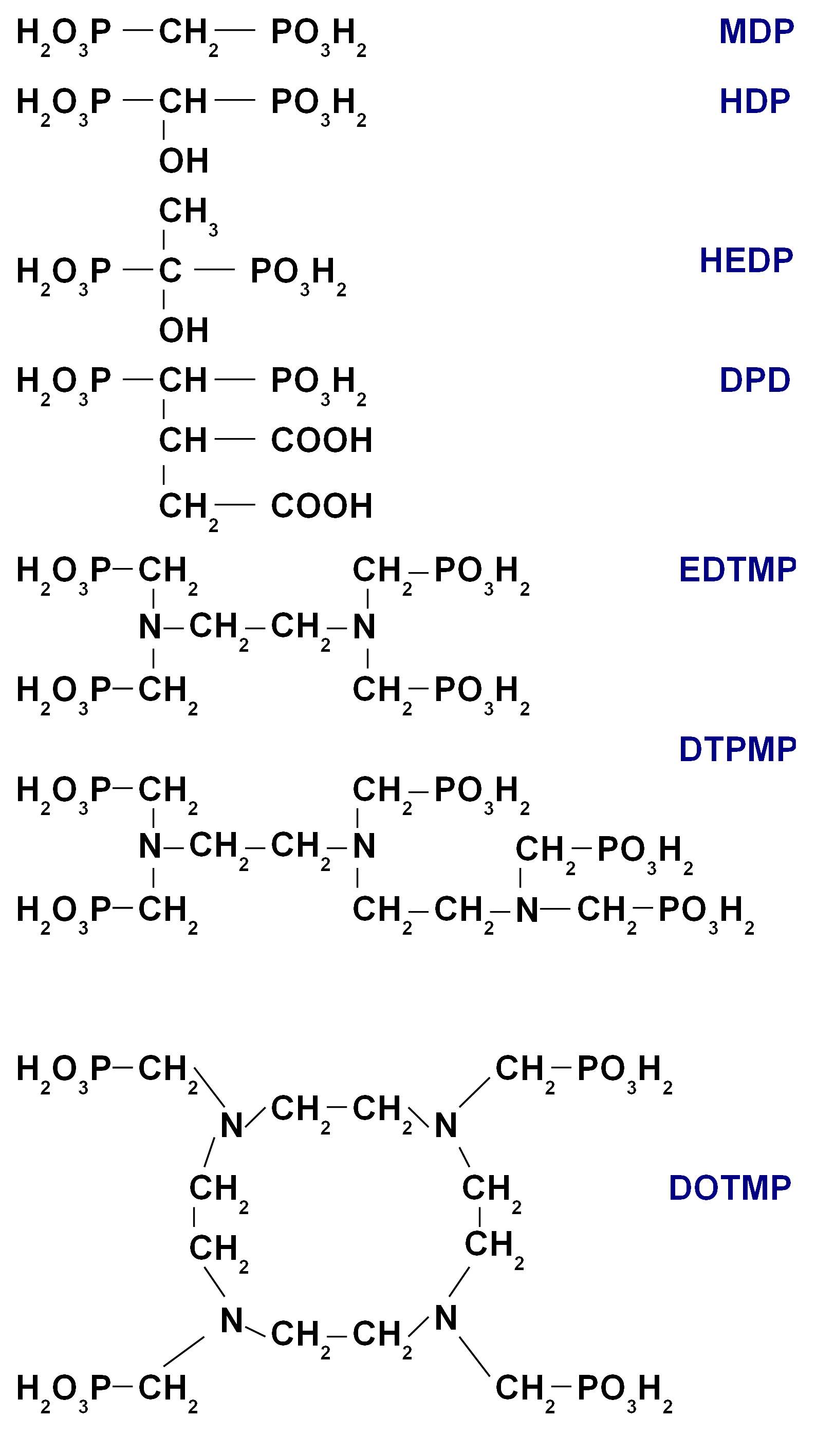
Budowa chemiczna bisfosfonianów (difosfonianów, dwufosfonianów) stosowanych w medycynie nuklearnej (leki o podobnej strukturze mają również zastosowanie w medycynie konwencjonalnej, cechują się wysokim powinowactwem do tkanki kostnej):
- MDP (methylene diphosphonate, medronate)
- HDP (hydroxymethylene diphosphonate, oxidronate)
- HEDP (hydroxyethylidene diphosphonate)
- DPD (dicarboxypropane diphosphonate)
- EDTMP (ethylenediamine tetra methylene-phosphonate)
- DTPMP (diethylenetriamine penta methylene-phosphonate)
- DOTMP (1,4,7,10-tetraazacyclododecane tetramethylenephosphonate);
MDP, HDP oraz DPD (w Polsce najczęściej MDP) w połączeniu z 99mTc mają zastosowanie jako radioznaczniki do scyntygrafii układu kostnego.
HEDP (w połączeniu z 186Re lub 188Re) oraz EDTMP (w połączeniu z 153Sm) są przykładami radiofarmaceutyków stosowanych do leczenia przerzutów w układzie kostnym.
EDTMP, DTPMP i DOTMP są strukturalnymi analogami, odpowiednio, EDTA, DTPA i DOTA - z tą różnicą, że grupy karboksylowe (-COOH) zostały zastąpione grupami fosforanowymi (-PO3H2) w celu zwiększenia powinowactwa do tkanki kostnej. Spośród tych trzech związków najszerzej stosowany jest EDTMP.
Nazwą "halogeny" określamy pierwiastki należące do grupy 17 (dawniej VIIA lub VII głównej) układu okresowego: fluor (symbol: F, liczba atomowa: 9), chlor (symbol: Cl, l.a.: 17), brom (symbol: Br, l.a.: 35), jod (symbol: I, l.a.: 53) oraz astat (symbol: At, l.a.: 85). Pierwiastki te cechują się wysoką elektroujemnością i reaktywnością chemiczną (maleją w miarę wzrostu liczby atomowej) i dość podobnymi właściwościami chemicznymi. Chemia ostatniego z wyżej wymienionych pierwiastków - astatu - jest ze względu na jego wysoką promieniotwórczość najsłabiej poznana.
Chemia organiczna halogenów jest dobrze opisana, ponadto jod-131 jest jednym z najbardziej popularnych w medycynie nuklearnej radionuklidów (ze względu na dostępność). Z tych powodów związki chemiczne jodu zaskarbiły sobie trwałe miejsce w radiofarmacji. Późniejsze pojawienie się jodu-123 (korzystniejsze dla obrazowania właściwości fizyczne) oraz jodu-124 (β+-emiter dla techniki PET) dodatkowo przedłużyło zainteresowanie radiofarmaceutów wprowadzaniem jodu do związków organicznych. Stosunkowa niska trwałość (zwłaszcza organicznych) związków jodu, polegająca na łatwym odszczepianiu tego atomu od reszty molekuły i powodująca gromadzenie jodu w tarczycy, zdaje się nie być tutaj istotną przeszkodą... Typowym przykładem takiej substancji jest meta-jodobenzyloguanidyna (ang.: metaiodobenzylguanidine - mIBG).
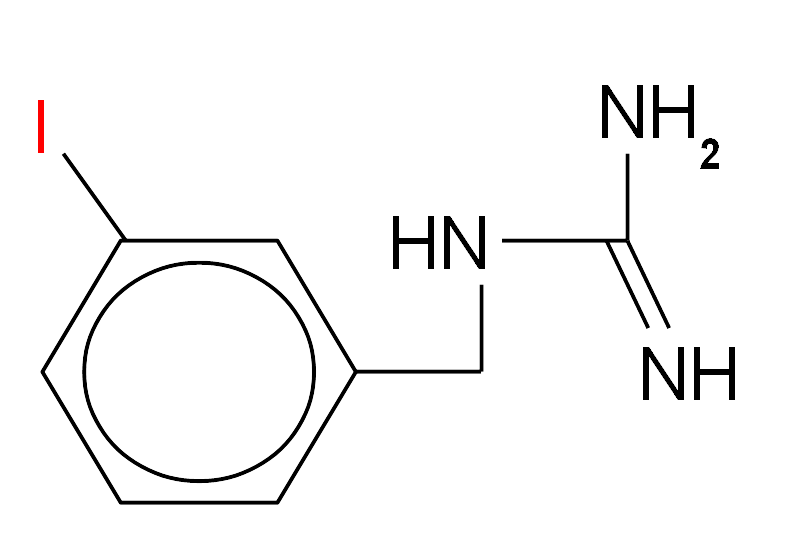
Struktura chemiczna meta-jodo-benzylo-guanidyny (mIBG); atomem jodu (oznaczony na czerwowo) jest najczęściej 123I (używany do celów diagnostycznych) lub 131I (używany głównie do terapii izotopowej).
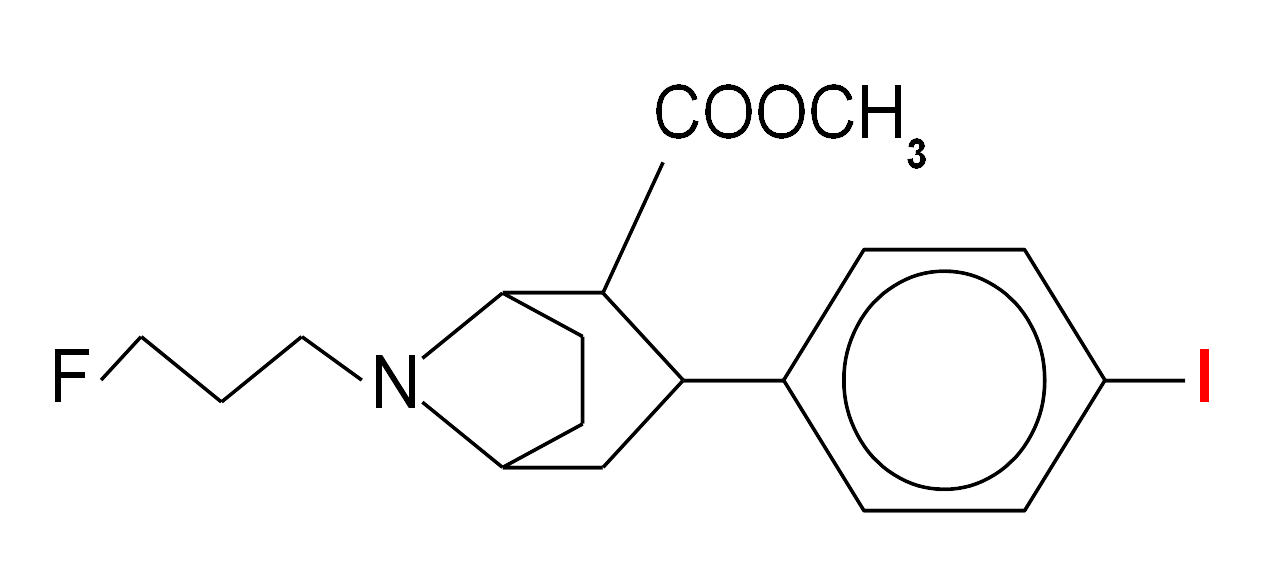
Struktura chemiczna ioflupane (DaTSCAN) - analogu kokainy stosowanego do badania transporterów dopaminowych w mózgu; atomem jodu (oznaczony na czerwowo) jest 123I.
Pojawienie się Fluoru-18 (najprostszy β+-emiter) spowodowało burzliwy rozwój badań nad związkami tego pierwiastka z substancjami organicznymi. Do najpopularniejszych tego typu połączeń należy 18F-FDG, czyli 18F-fluorodezoksyglukoza.
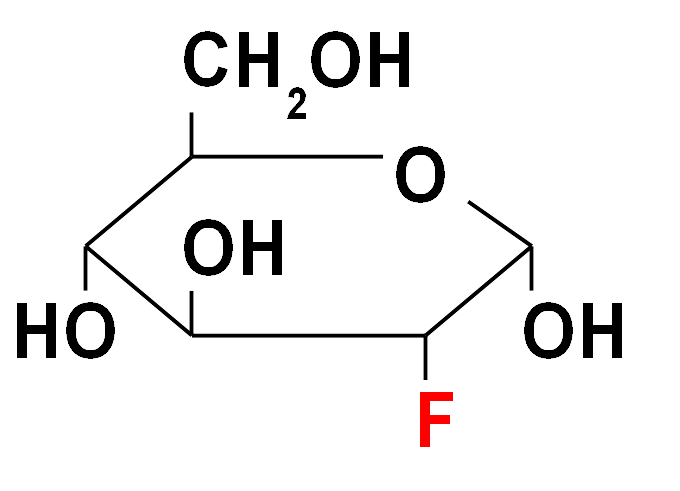
Struktura chemiczna FDG (fluorodezoksyglukoza, fluorodeoxyglucose) - do badania metabolizmu glukozy za pomocą techniki PET
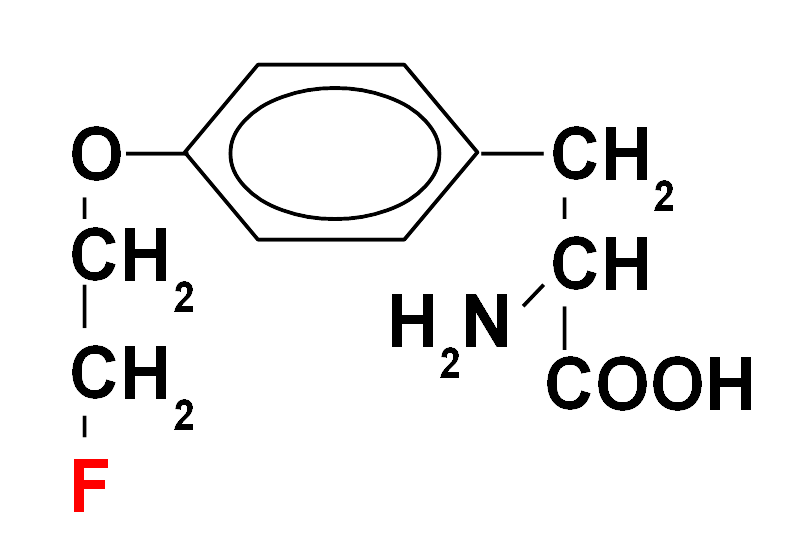
Struktura chemiczna FET (fluoroetylotyrozyna, fluoroethyltyrosine) - do badania transportu aminokwasów (głównie w neuroonkologii) za pomocą techniki PET
Krótki czas połowicznego zaniku stosowanych w medycynie nuklearnej nuklidów wymusza ich pozyskiwanie bezpośrednio w miejscu zastosowania, czyli w szpitalach/przychodniach prowadzących diagnostykę i/lub terapię radioizotopową. Jednym z wyjątków jest jod-131 stosowany do leczenia tarczycy, którego stosunkowo długi czas połowicznego zaniku pozwala na wytwarzanie z dala od miejsca zastosowania.
Pozyskiwanie radionuklidów o krótkim czasie połowicznego zaniku wymaga zazwyczaj albo wyposażenia pracowni w akcelerator (np. cyklotron) albo, o ile pozwalają na to warunki fizyko-chemiczne, w generator. Cyklotron, wraz z wyposażeniem m.in. w całą potrzebną aparaturę radiochemiczną, jest jednak urządzeniem bardzo drogim.
Generator można skonstruować tylko pod warunkiem, że potrzebny radionuklid (o krótkim czasie połowicznego zaniku) może powstawać wskutek rozpadu promieniotwórczego nuklidu macierzystego ("nuklidu-matki") o długim czasie połowicznego zaniku. Przykłady generatorów radionuklidowych:
1. Generator molibdenowo-technetowy: 99Mo (rozpad: β-, T(1/2)= 66 h) → 99mTc (wydajność z 99Mo: 87,5 %; rozpad: przejście izomeryczne z emisją γ 140 keV, T(1/2)= 6,02 h) - używany w większości pracowni medycyny nuklearnej do obrazowania planarnego i SPECT;
2. Generator wolframowo-renowy: 188W (rozpad: β-, T(1/2)= 69,78 d) → 188Re (rozpad: β-, T(1/2)= 17 h, średnia energia: 763 keV
3. Generator germanowo-galowy: 68Ge (rozpad: wychwyt elektronu, T(1/2)= 270,95 d) → 68Ga (rozpad: β+,
4. Generator tytanowo-skandowy: 44Ti (rozpad: wychwyt elektronu, T(1/2)= 60 lat) → 44Sc (rozpad: β+, T(1/2)= 3,97 h - 94,3%) - eksperymentalny (jeszcze...) w obrazowaniu PET;
Najbardziej znanym jest generator molibdenowo-technetowy służący do uzyskiwania technetu-99m.
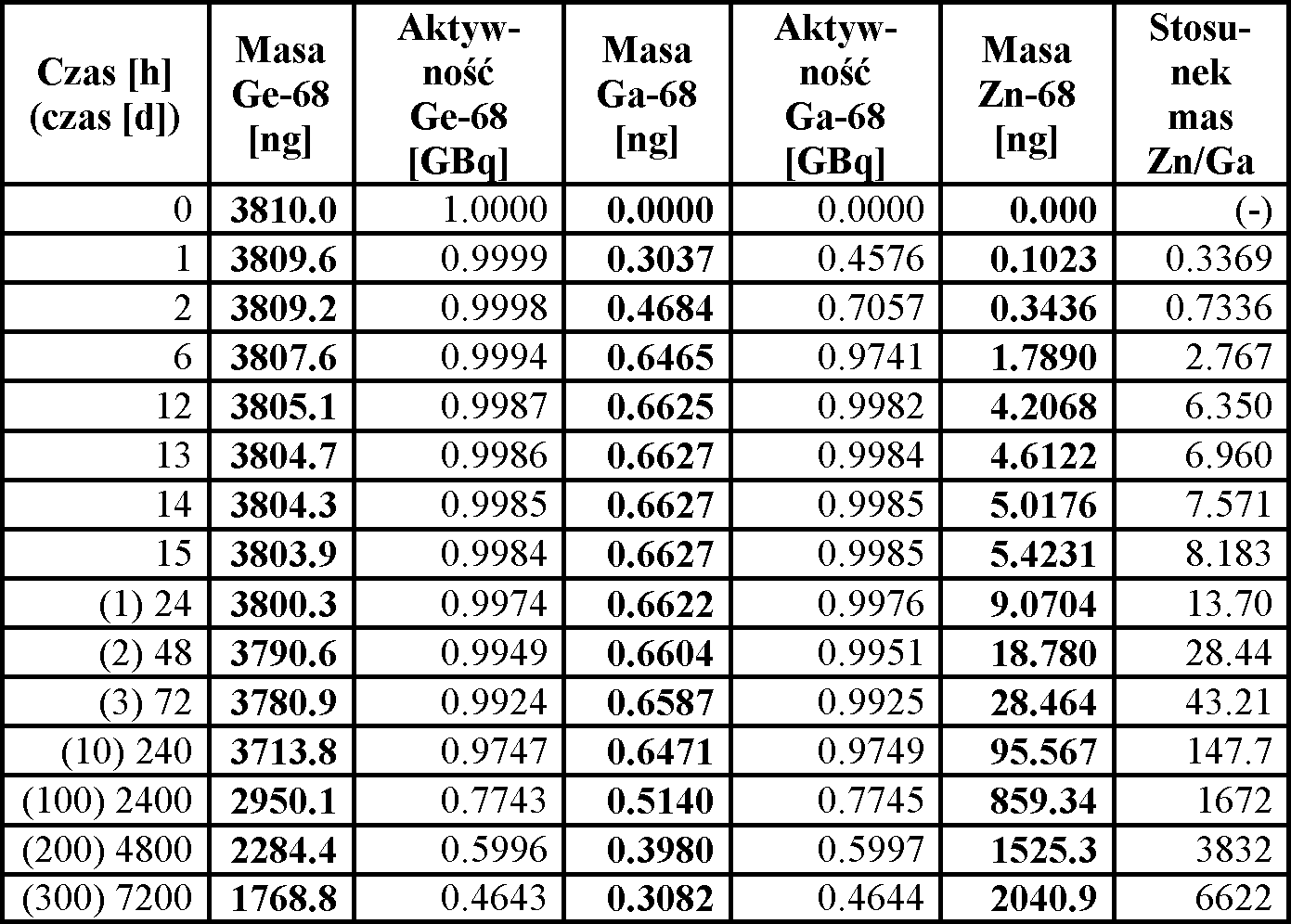
Pierwszym problemem przy pracy z takimi generatorami jest niskie stężenie związku danego radionuklidu w uzyskanym roztworze z generatora. Stężenie to jest niższe nieraz o wiele rzędów wielkości od stężeń innych substancji występujących w tym roztworze, na przykład powstających w wyniku rozpadu tego nuklidu. Ta przeszkoda w kilku przypadkach znacznie opóźniła konstrukcję generatora. Szerzej o mechanizmie znaczenia tych problemów wspomniano powyżej. Poniżej zamieszczono tabelkę z zawartościami poszczególnych nuklidów w generatorze germanowo-galowym. Obrazuje ona nie tylko niską zawartość masową interesujących nas substancji, ale także na przykład konieczność częstej elucji (przemywania) takiego generatora w celu oddzielania produktów rozpadu. Na tej witrynie można również zobaczyć podobną tabelkę o generatorze molibdenowo-technetowym.
 |
|
Objaśnienia: Rozpad odbywa się zgodnie ze schematem: 68Ge (T1/2 = 271 d = 6504 h) → 68Ga (T1/2 = 68 min. = 1,133 h) → 68Zn (trwały). Maksimum aktywności 68Ga przypada 14,15 h (849 min., czyli 14 h 9 min.) po elucji. Generator o aktywności 1 GBq (w momencie ostatniej elucji) zawiera początkowo 3810 ng W kolumnie 1. - czas, jaki upłynął od tego momentu, w kolumnach 2. i 3. - masa (M) i aktywność (A) 68Ge w danym czasie, w kolumnach 4. i 5. - masa (M) i aktywność (A) 68Ga w danym czasie, w kolumnie 6. - masa 68Zn, w ostatniej kolumnie - stosunek masy 68Zn do masy 68Ga. |
Chemia radionuklidów stosowanych w medycynie nuklearnej jest podobna (czy wręcz taka sama) do chemii izotopów stabilnych tego samego pierwiastka lub jego izotopów o dłuższym czasie połowicznego zaniku. Jeśli takowe izotopy nie istnieją (jak to ma miejsce na przykład w przypadku astatu), uniemożliwia to dokładne poznanie chemii tego pierwiasta i jest istotną przeszkodą w jego praktycznym zastosowaniu.
Technet-99m z generatora molibdenowo-technetowego uzyskiwany jest w postaci roztworu nadtechnetanu (nadtechnecjanu) sodowego (Na99mTcO4) - oczywiście zdysocjowany do kationu sodowego (Na+) i anionu nadtechnetanowego (nadtechnecjanowego - TcO4-). Technet znajduje się w tym związku na +7. stopniu utleniania. W tej postaci może być stosowany tylko w badaniach tarczycy (obrazuje transport - ale już nie organifikację - anionów jodkowych) oraz, rzadziej, ślinianek. Do tworzenia stosowanych w medycynie nuklearnej kompleksów musi zostać uprzednio zredukowany do niższego stopnia utleniania, najczęściej +4 i +5. Dokonuje się tego w praktyce zazwyczaj za pomocą soli cyny (Sn+2 utlenia się przy tym do Sn+4).
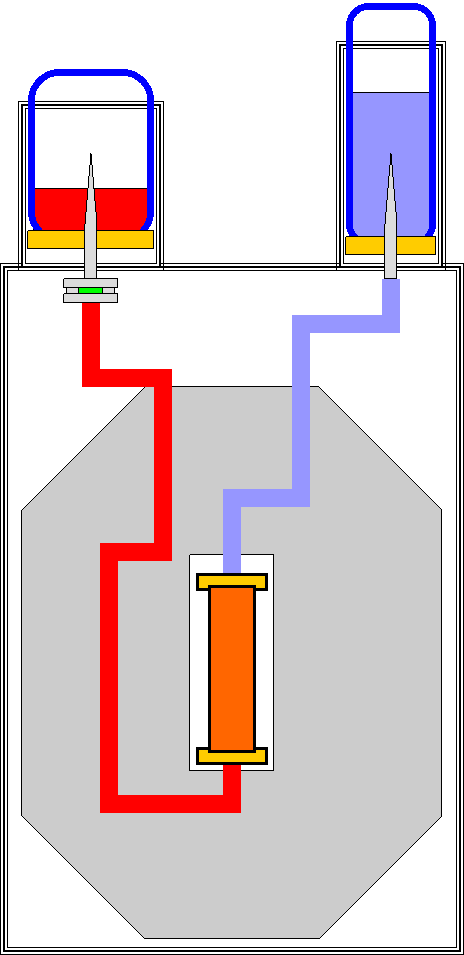
Schemat działania generatora radionuklidowego na przykładzie generatora molibdenowo-technetowego; kolumna z zaadsorbowanym na trójtlenku glinu (Al2O3) molibdenianem sodu (Na299MoO4) znajduje się wewnątrz grubej osłony ołowianej (kolor szary).
U góry po stronie prawej umieszcza się fiolkę z wodą (kolor niebieski), po stronie lewej - fiolkę z podciśnieniem. Zasysa ona wodę, która przepływając przez kolumnę wypłukuje z niej nadtechnetan sodu (eluat, czyli wodę zawierającą nadtechnetan, zaznaczono kolorem czerwonym). Eluat zawiera nadtechnetan, w którym technet znajduje się na dwóch poziomach energetycznych: Na99mTcO4 oraz produkt jego rozpadu - Na99TcO4. Celem zapewnienia sterylności przed wpłynięciem do fiolki przechodzi on przez filtr przeciwbakteryjny (zielony).